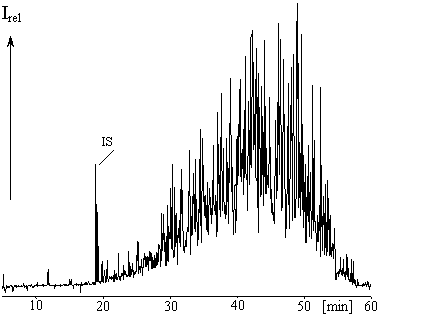
Abb.: GC/ECD-Chromatogramm von Toxaphen
Das komplexe Chlorpestizid "Toxaphen" (Camphechlor) ist seit vielen Jahren ein wichtiger Bestandteil unserer Forschung. Das technische Gemisch, das vorrangig in den 1970er Jahren in mit DDT vergleichbaren Mengen eingesetzt worden war, besteht aus über 1000 Komponenten, von denen auch heute noch weniger als 10% strukturell bekannt sind.

Übrigens sind allein von der Hauptklasse in Toxaphen, den chlorierten Bornanen, 16640 und unter Einbeziehung von Enantiomeren gar 32767 unterschiedliche Vertreter denkbar (Chemosphere 26 (1993) 1079-1086). Für die Chlorbornane wurde in Zusammenarbeit mit Paul Andrews (ehemals Health Canada) auf der Basis von IUPAC-Regeln ein Nomenklatursystem entwickelt, das als Online-Version und freier Download auf unserer Homepage abgelegt ist (=>Nomenklatursystem).
Toxaphen wurde hauptsächlich in den USA, aber auch in der ehemaligen Sowjetunion und der ehemaligen DDR hergestellt und vermarktet.
Am Thema näher interessierte Leser seien an den Übersichtsartikel "Toxaphene. Analysis and Environmental Fate of Congeners", in "The Handbook of Environmental Chemstry (Volume 3, Part K: New Types of Persistent Halogenated Compounds Ed. J. Paasivirta, Springer Verlag, Berlin Heidelberg, 2000, S. 237-287) verwiesen.
In der Umwelt werden viele dieser compounds of technical toxaphene (CTTs) abgebaut, so dass auch in Lebensmittelproben weit weniger Toxaphenkomponenten vorliegen und im Menschen sogar nur zwei Hauptverbindungen und ein paar wenige Minorverbindungen nachgewiesen werden können.
Eines unserer Hauptziele war es daher seit 1994, die strukturellen Voraussetzungen für die Persistenz einzelner CTTs in höheren Organismen zu ermitteln. Dazu wurden neue analytische Methoden entwickelt, persistente CTTs isoliert und ihre Struktur aufgeklärt (z. B. Environ. Sci. Technol. 31 (1997) 3023-3028; J. Agric. Food Chem. 49 (2001) 759-765) und in Zusammenarbeit mit Gerd Scherer (Basel) mit Hilfe des molecular modellings untersucht (Environ. Sci. Technol. 33 (1999) 3458-3461). Heute kennen wir die Struktur von acht der elf in Robben aus der Antarktis nachgewiesenen CTTs, und sechs davon wurden in unserem Labor identifiziert (Focus-Artikel).
Seit 1998 untersuchten wir auch die Prozesse, die beim anaeroben Abbau in Böden und Sedimenten eine Rolle spielen. In einer langjährigen Zusammenarbeit mit meinem US-amerikanischen Kollegen Keith Maruya vom Skidaway Institute of Oceanography bei Savannah/Georgia (USA) wurde auch der Übergang einzelner CTTs aus mit Toxaphen kontaminiertem Sediment in die Nahrungskette und deren anschließendes Schicksal in Fisch untersucht (Environ. Sci. Technol. 34 (2000) 1627-1635; Environ. Toxicol. Chem. 19 (2000) 2198-2203; Environ. Sci. Technol. 35 (2001) 4444-4448; Environ. Sci. Technol. 39 (2005) 3999-4004).
Parallel dazu wurden auch Laborversuche aufgebaut. Dabei ist es ein Ziel unserer Arbeiten, durch die Kenntnis der Abbauwege Strategien zu entwickeln, um Toxaphen-Rückstände in der Umwelt so effektiv abzubauen, dass möglichst wenig Toxaphen-Verbindungen über die Nahrungskettenanreicherung schließlich in Lebensmitteln gelangen können.
Nach anfänglichen Versuchen mit anaerobem Faulschlamm aus der Kläranlage (Environ. Sci. Technol. 35 (2001) 960-965), setzten wir nun in Zusammenarbeit mit der Mikrobiologin Anke Neumann (Universität Karlsruhe) zur Dehalogenierung befähigte Mikroorganismen ein. Mit Hilfe des anaeroben Bakteriums Sulfurospirillum multivorans (ehemals Dehalospirillum multivorans) aus dem Hause von Gabrielle Diekert (Universität Jena) konnten hierbei gute und vielversprechende Erfolge erzielt werden. Mit diesem Bakterium können nämlich alle persistenten CTTs, die vom Menschen angereichert werden, in niederchlorierte CTTs umgewandelt werden, die wiederum vom Menschen und Fisch schnell und leicht abgebaut werden können (Environ. Toxicol. Chem. 18 (1999) 2775-2781; Environ. Toxicol. Chem. 22 (2003) 2614-2621). Auch der ungekehrte Fall, nämlich dass die in Säugern persistenten Toxaphenverbindungen sowie weitere Organohalogenrückstände leicht von S. multivorans abgebaut werden können, konnte von uns gezeigt werden (Toxcol. Environ. Chem. 87(2005) 229-235).
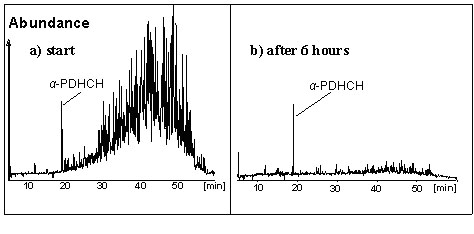
Die Entdeckung des Corrinoids als Co-Faktor in den o. g. Bakterium legte nahe, den anoxischen Abbau des Toxaphens abiotisch mit Hilfe von verfügbaren Corrinoiden zu untersuchen. Wird das Zentralatom der Corrinoide - Co - mit einem geeigneten Reduktionsmittel wie Titan(III)citrat in die Oxidationsstufe CoI überführt, so kann das entsprechende Corrinoid effizient Organohalogenverbindungen reduktiv dehalogenieren. Auf diesem Weg "arbeiten" auch Bakterien. Mit Hilfe der superreduzieten Corrinoide Cyanocobalamin (CCA, superreduziertes Vitamin B12) und v.a. mit Dicyanocobinamid (DCC) gelang - wie Abb. unten zeigt - binnen Stunden ein effizienter Toxaphenabbau (Environ. Sci. Technol. 38 (2004) 3063-3067; Organohalogen Compd. 66 (2004) 288-2293).
Daneben gilt unser Interesse dem Nachweis, aus welcher Quelle Toxaphenrückstände in Lebensmitteln stammen. So konnten die beiden technischen Produkte Melipax® und Toxaphen® mit Hilfe der Stabilisotopenmassenspektrometrie (IRMS) unterschieden werden (Chemosphere 58 (2005) 235-241).