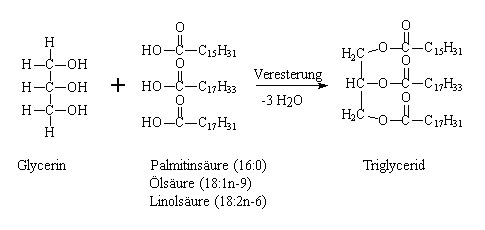
Fettsäuren, d. h. Carbonsäuren ab einer Kettenlänge von C4 (Buttersäure), sind als zentrale Bausteine der Lipide ein wesentlicher Hauptbestandteil von Lebensmitteln. Dort liegen sie meist verestert mit Glycerin (1,2,3-Trihydroxypropan, Propantriol) als sogenannte Triglyceride vor:
Neben der Bestimmung des Fettgehaltes eines Lebensmittels (z. B. auf der Verpackung der meisten Lebensmittel angegeben) ist die Bestimmung einzelner Fettsäuren ein wichtiges Instrument zur Charakterisierung der Eigenschaften von Lebensmitteln.
Fettsäuren unterscheiden sich nicht nur hinsichtlich der Kettenlänge (gesättigte Fettsäuren), sondern sie können auch unterschiedlichen Sättigungsgrad (Vorkommen von Doppelbindungen, „einfach bis sechsfach ungesättigt“) aufweisen. Bei ungesättigten Fettsäuren kann die Lage und Konfiguration von Doppelbindungen (cis- und trans-Fettsäuren) variieren. Bei der Angabe der Lage geht man üblicherweise vom Ende des Moleküls aus und gibt die Stelle des endständigen C-Atoms (dieses wird als n oder -veraltet auch- omega bezeichnet) an. Die entsprechenden Fettsäuren verschiedener Kettenlänge werden in so genannten Familien (n-3 = omega-3, n-6 und n-9) zusammen gefasst. Liegen im Fettsäuremolekül mehrere Doppelbindungen vor, so handelt es sich üblicherweise um isolierte Doppelbindungen, d. h. zwischen sp2-hybridisierten C-Atomen liegt eine CH2-Einheit vor. In geringen Mengen können aber auch konjugierte Doppelbindungen vorkommen (konjugierte Linolsäuren, CLA).
Das mögliche Spektrum an Fettsäuren erweitert sich noch dadurch, dass an verschiedenen Positionen Verzweigungen (vorrangig Methylgruppen), funktionelle Gruppen (z. B. Hydroxylreste) und andere Reste (z. B. Cyclohexyl) in der Kette vorliegen.
Aus diesen Strukturvarianten und ihren Kombinationen ergibt sich eine Vielzahl von Fettsäuren, die in Lebensmitteln mit unterschiedlichen Anteilen vorkommen können.
Zwar sind Palmitin-, Öl- und Linolsäure (vgl. Abbildung 1) gewöhnlich die mengenmäßig am häufigsten vorkommenden Fettsäuren in Lebensmitteln (jeweils im ein- bis zweistelligen Prozentbereich), doch sind es weniger diese Fettsäuren, welche von ernährungsphysiologischem oder technologischem Interesse sind. Dort spielen mehrfach ungesättigte Fettsäuren (insbesondere
Unsere Interessen liegen in der umfassenden analytischen Bestimmung von Fettsäuren in Lebensmitteln mit dem Schwerpunkt verzweigtkettiger Fettsäuren.
Für die Bestimmung der Fettsäuren müssen zunächst weitere Lebensmittelbestandteile (u. a. Proteine und Kohlenhydrate) von der Lipidfraktion abgetrennt werden. Wir gewinnen die lipophilen Komponenten mit Hilfe der mikrowellenunterstützten Extraktion in offenen Gefäßen (FOV-MAE) (Batista et al., 2001) oder der beschleunigten Lösungsmittelextraktion (ASE). Mit diesen schnellen und effizienten Verfahren können zeitaufwändige und umständliche Methoden zur Lipidextraktion wie die Methode nach Bligh und Dyer (für Fischproben) und die Soxhlet-Extraktion ersetzt werden. Die in den gewonnenen Fetten vorliegenden Fettsäuren werden nach Entfernung des Lösungsmittels umgeestert und mittels GC/MS und GC/FID zur Bestimmung des Fettsäuremusters herangezogen. Zur Derivatisierung von Fettsäuren (Herstellung der Fettsäuremethylester=FAME und anderer Derivate) setzen wir verschiedene Methoden ein (z. B. BF3/MeOH, TMSH, TMAH). Die GC-Trennung erfolgt vorrangig an stationären Phasen mit hohem Cyanopropylanteil.
Bei früheren Untersuchungen hatte sich bereits gezeigt, dass in Lebensmitteln häufig Fettsäuren vorkommen, für die keine Referenzstandards kommerziell verfügbar sind. Für die umfassende GC-Bestimmung aller Fettsäuren ist somit der Einsatz der GC/MS unumgänglich. Auf diese Weise können auch die bei allen stationären Phasen unvermeidlichen Koelutionen von Fettsäuren erkannt und nachgewiesen werden. Dabei können zunächst Fettsäuremethylester (FAME) eingesetzt werden, anhand derer das Molekülion ermittelt werden kann (dieses gibt Aufschluss über die Summenformel und auch die Zahl von Doppelbindungen). Allerdings sind Massenspektren von FAME nur von geringem Aussagewert, da die Bildung des Molekülions nicht nur an der Kopfgruppe erfolgt, sondern im Fall von ungesättigten Fetts¨uren in nicht unerheblichem Maße auch in der Kette zu finden ist. Dies führt durch Mesomeriestabilisierung zu Migrationen der Doppelbindung(en), so dass deren ursprüngliche Lage anhand der erhaltenen Massenspektren nicht ermittelt werden kann. Zur Bestimmung der Positionen von Doppelbindungen in Fettsäuren werden keine FAME eingesetzt, sondern hauptsächlich Derivate, bei denen die Carboxyl-Gruppe der Fettsäure in eine stickstoffhaltige funktionelle Gruppe („remote-site derivatization method“) überführt wurde (Pyrrolidide, Piperidyle, Picolinylester, Triazolpyridine, 2-Alkenylbenzoxazole und 4,4-Dimethyloxazoline). In diesem Fall wird das Molekülion praktisch ausschließlich in der Kopfgruppe gebildet (das Stickstoffatom und nicht der Alkylrest trägt die Ladung), so dass sowohl die Ionenbildung an Doppelbindungen und als Folge deren Migration minimiert und damit eine genaue Lage von Doppelbindungen, aber auch von Verzweigungen festgestellt werden kann. Eine detaillierte Beschreibung der Massenspektren von Fettsäurederivaten findet sich bei
Christie.
Unsere Strategie beruht auf einer GC/MS-SIM-Methode, anhand der eine umfassende Erfassung von gesättigten (verzweigt und geradkettig) und ungesättigten (einfach bis sechsfach) Fettsäuren in Lebensmitteln möglich ist, auch wenn deren Anteile am Fettsäuremuster nur gering sind. Dies ist wichtig, weil ein Hauptaugenmerk auf das Vorkommen und die Bedeutung von verzweigtkettigen Fettsäuren in den jeweiligen Proben gerichtet ist.
Wie bereits erwähnt, werden Fettsäuren auch heute noch vorrangig mittels GC/FID bestimmt. Die Nachteile der Methodik liegen auf der Hand: zum einen zeigt der FID alle organischen Verbindungen an und ist somit ausgesprochen unselektiv; zum anderen ist die Empfindlichkeit des Detektors zwar ausreichend für die Bestimmung der Hauptfettsäuren, doch sind der Bestimmung von Minorfettsäuren Grenzen gesetzt. Sollen gerade Minorfettsäuren sicher bestimmt werden, sind die Möglichkeiten mit GC/FID schnell ausgereizt. Daher war unser Ziel, eine Nachweismethode zu entwickeln, die es erlaubt, Major- und Minorfettsäuren gleichermaßen sicher quantitativ zu erfassen. Dass dabei die GC/MS Vorteile bieten würde war klar. Allerdings sollte diese nicht wie üblich im Full Scan Modus sondern im Selected Ion Monitoring (SIM) Modus eingesetzt werden, denn bei Einsatz von Quadrupolgeräten kann mit dem Einzelionennachweis die Nachweisgrenze und Signalreproduzierbarkeit wesentlich verbessert werden. Die Frage war, welche Fettsäurederivate sich am besten für die GC/MS-SIM-Bestimmung eigneten. Aufgrund der nahezu endlosen Zahl von theoretisch möglichen Fettsäuren, von denen viele Vertreter je nach Kettenlänge, Sättigungsgrad und stationärer GC-Phase im selben Elutionsbereich eluieren, schien es aussichtslos für alle möglichen Molekülionen Zeitfenster zu entwickeln. Daher fiel unsere Wahl auf Methylester. Aus Abb. 2 geht hervor, dass sich die Massenspektren der Methylester von Fettsäuren mit gleicher Kettenlänge und unterschiedlicher Zahl von Doppelbindungen stark unterscheiden (J. Agric. Food Chem. 53 (2005): 8896-8903).
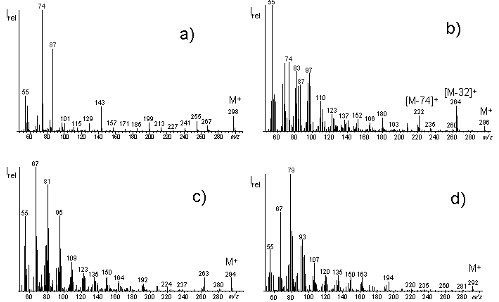
Weisen gesättigte FS generell das McLafferty-Ion (m/z 74) als intensivstes Ion (Basision) und das durch β-Spaltung gebildete m/z 87 als zweitintensivstes Fragmention auf (Abb.3), nimmt deren Bedeutung bei Monoensäuren ab, doch sind beide Fragmentionen bei dieser Fettsäureklasse weiterhin stark vertreten(Abb. 2a und 2b). Diese Situation ändert sich völlig, wenn mehrere Doppelbindungen vorliegen. Bei zwei (Abb. 2c) und >2 Doppelbindungen (Abb. 2d) treten m/z 74 und m/z 87 praktisch nicht mehr in den Massenspektren auf (J. Agric. Food Chem. 53 (2005): 8896-8903).
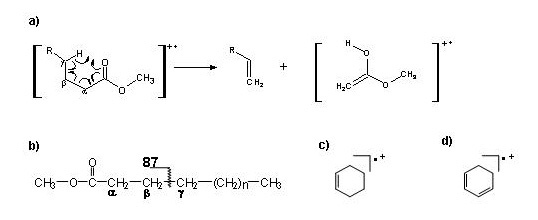
Andererseits waren im höheren Massenbereich weder das Molekülion noch Fragmentionen empfindlich nachweisbar. Allerdings wurden bei allen mehrfach ungesättigten Fettsäuren (PUFA) mit m/z 79 und m/z 81 relativ charakteristische Fragmentionen nachgewiesen. Die folgende Abbildung zeigt, dass die Bildung der eben beschriebenen Fragmentionen innerhalb der gleichen Fettsäureklasse weitgehend von der Kettenlänge unabhängig war.
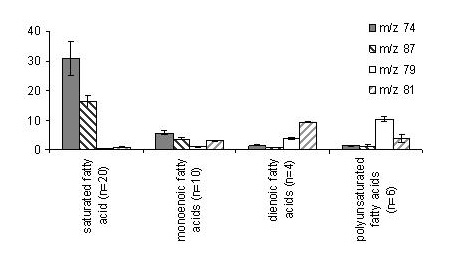
Aufbauend auf diesen Befunden wurden Fettsäuren wie folgt bestimmt: Gesättigte Fettsäuren zeigten zwar für m/z 74 die höchste Intensität, doch variierte der Beitrag von m/z 87 zum Totalionenstrom mit unterschiedlicher Kettenlänge weniger, so dass alle gesättigten Fettsäuren durch Bestimmung von m/z 87 und Multiplikation mit dem mittleren Faktor 6,0 (dieser repräsentiert den Anteil des betreffenden Ions am Gesamtionenstrom) gut bestimmt werden können. Gleichermaßen gelingt dies bei Monoensäuren unter Anwendung von m/z 87 und Multiplikation mit dem Faktor 17,9. Für PUFA erwies sich die Summe m/z 79 + m/z 81 multipliziert mit dem Faktor 7,7 als optimal (J. Agric. Food Chem. 53 (2005): 8896-8903). Durch Entwicklung definierter Auswahlkriterien kann die richtige Zuordnung einer Fettsäure zur jeweiligen Gruppe abgesichert werden (für Details siehe J. Agric. Food Chem. 53 (2005): 8896-8903). Auf diese Weise lassen sich Fettsäuren in Lebensmitteln annähernd genau wie mittels GC/FID bestimmen, bei gleichzeitig verbesserter Selektivität und Sensitivität (J. Agric. Food Chem. 53 (2005): 8896-8903).
Methylverzweigungen liegen bei Fettsäuren häufig in n-1-Position (so genannte Isofettsäuren) und in n-2-Position (so genannte Anteisofettsäuren) vor:
Die Nomenklatur der verzweigtkettigen Fettsäuren (weitere verzweigtkettige Fettsäuren) erfolgt durch Benennung der längsten geradlinigen Kette und Angabe der Position(en) sowie der Art der Verzweigung(en). So ist die in Abbildung 2 gezeigte Isopentadecansäure als 13-Methyl-Tetradecansäure (Abkürzung i15:0) und die Anteisopentadecansäure systematisch als 12-Methyl-Tetradecansäure (a15:0) zu bezeichnen.
Über die Nahrung werden vom Menschen täglich ca. 0,5 g verzweigtkettige Fettsäuren (im Vergleich dazu 8,54 g Stearinsäure, 18:0) konsumiert. Dabei sind Milch (nicht nur Kuhmilch) und Milchprodukte wichtige Quellen, wobei dort mitunter über 30 verschiedene verzweigtkettige Fettsäuren nachgewiesen werden können. Niedermolekulare verzweigtkettige Fettsäuren sind mitverantwortlich für das Aroma von Milchfett und auch wichtige Aromakomponenten in Käse. Auch in Humanmilch kommen mehr als zehn verzweigtkettige Fettsäuren vor. Des Weiteren sind sie Bestandteile der menschlichen Haut und des Epidermisfettes verschiedener Tiere.
Auch andere Tiere und Pflanzen (Rindertalk, marine Organismen, Algen, Tabak, Samen und Öle) enthalten verzweigtkettige Fettsäuren, so dass sie in Lebensmitteln üblicherweise mit Anteilen von 0,5-4 % und damit in vergleichbaren Mengen wie konjugierte Linolsäuren und trans-Fettsäuren vorliegen. Allerdings wurde ihnen bisher nur vergleichsweise geringe Bedeutung zugemessen.
Das Vorkommen von verzweigtkettigen Fettsäuren wird häufig mit der Pr&aul;senz von Bakterien in Verbindung gebracht (so enthält etwa Milch „keimfreier“ Tiere wesentlich geringere Anteile). Kommen verzweigtkettige Fettsäuren in Eukaryonten nur in geringen Mengen vor, so spielen sie in Prokaryonten eine wesentliche Rolle. Beispielsweise kann ihr Anteil in Bakterien bis zu 80 % des gesamten Fettsäuremusters ausmachen.
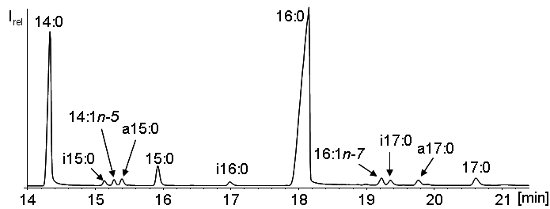
Aus den bekannten Wegen der Biosynthese verzweigtkettiger Fettsäuren geht hervor, dass überwiegend solche mit ungerader C-Zahl und dabei insbesondere die Iso- und Anteisofettsäuren mit 15 und 17 C-Atomen (i15:0, a15:0, i17:0 und a17:0) gebildet werden. Von der GC-Elutionsfolge ist bekannt, dass bei gleicher Kettenlänge Isofettsäuren vor Anteisofettsäuren und beide vor dem unverzweigtkettigen Isomer eluieren (vgl. Abbildung 6).
Verzweigtkettige Fettsäuren in natürlich vorkommenden Mengen sind auch als Additive zur Herstellung von Lebensmittelbedarfgegenständen aus Kunststoff erlaubt.
Durch die Verzweigung am Kettenende verändern sich die physikochemischen Eigenschaften wie die Phasenumwandlungstemperatur von Lipiden. Dabei erhöht eine endständige Verzweigung den Druck und reduziert die Enthalpieänderung beim Phasenübergang. Daher sind Iso- und Anteisofettsäuren wichtig für die Membraneigenschaften von Lipiden, denn diese stören die Orientierung mit ähnlichen Konsequenzen wie Doppelbindungen.
Bakterien wirken wechselnden Temperaturen häufig durch eine Veränderung der Fettsäurezusammensetzung zur Erhaltung der Lipidfluidität (homeoviskose Adaption) entgegen. Dies kann durch Erhöhung des Anteils einfach ungesättigter Fettsäuren (Bakterien stellen generell keine mehrfach ungesättigten Fettsäuren her), Verkürzung der durchschnittlichen Kettenlänge und/oder durch die vermehrte Produktion verweigtkettiger Fettsäuren erfolgen. Es ist z. B. bekannt, dass das Bakterium Listeria monocytogenes (Verursacher der durch Lebensmittelkonsum hervorgerufenen, häufigen Infektionskrankheit Listeriose) im Falle einer Abkühlung (Kühlschrank) seine Membranfluidität durch vermehrte Produktion von verzweigtkettigen Fettsäuren aufrecht erhält und der Erreger somit durch Abkühlen und Gefrieren der Lebensmittel nicht abgetötet wird, sondern unter Umständen sogar wächst.
Aufgrund ihres hervorragenden Spreitungsvermögens, ihrer Oxidationsbeständigkeit und ihres niedrigen Schmelzpunktes werden verzweigtkettige gesättigte Fettsäuren auch in Kosmetika eingesetzt.
Übrigens werden verzweigtkettige Fettsäuren und ihre Abbauprodukte für das „Aroma“ und die pheromonische Wirkung von Widdern auf weibliche Tiere verantwortlich gemacht.
Enantioselektive Prozesse spielen in der Natur eine wichtige und oftmals entscheidende Rolle, viele Biosynthesen laufen streng enantioselektiv ab. Zwar ist die Chiralität von Aminosäuren (überwiegend L-Formen) und Kohlenhydraten (überwiegend D-Formen) hinreichend untersucht worden, doch wurde die Bedeutung der Chiralität bei der dritten großen Gruppe von Lebensmittelinhaltstoffen - den Lipiden - bisher kaum berücksichtigt.
Lipide werden häufig allzu schnell als achirale Lebensmittelhauptbestandteile abgetan. Dies ist nur bedingt richtig, denn die Vielzahl der Triglyceride (alle mit R1 ≠ R3) und die Phospholipide sind chiral. Aber auch bestimmte Fettsäuren sind chiral.
Unter den chiralen Fettsäuren ohne zusätzliche funktionelle Gruppe spielen die bereits erwähnten Anteisofettsäuren die größte Rolle in Lebensmitteln.

Einen weiteren Schwerpunkt unserer Arbeiten bildet die enantioselektive Untersuchung von Fettbestandteilen.
Für die Bearbeitung des Themenkomplexes werden von uns GC/MS- und GC/FID-Systeme sowie ein HPLC-System eingesetzt.